如何帮助大脑运动皮层受损的中风患者恢复运动能力?西达赛奈医疗中心(Cedars-Sinai Medical Center)的 Tanuj Gulati 和 Rohit Rangwani 等研究人员将目光投向了小脑。他们在一项临床前研究中成功证明,即便在运动皮层受损后,依然可以利用小脑的神经信号来直接控制外部假肢装置,为开发新型脑机接口和中风康复策略开辟了全新道路。
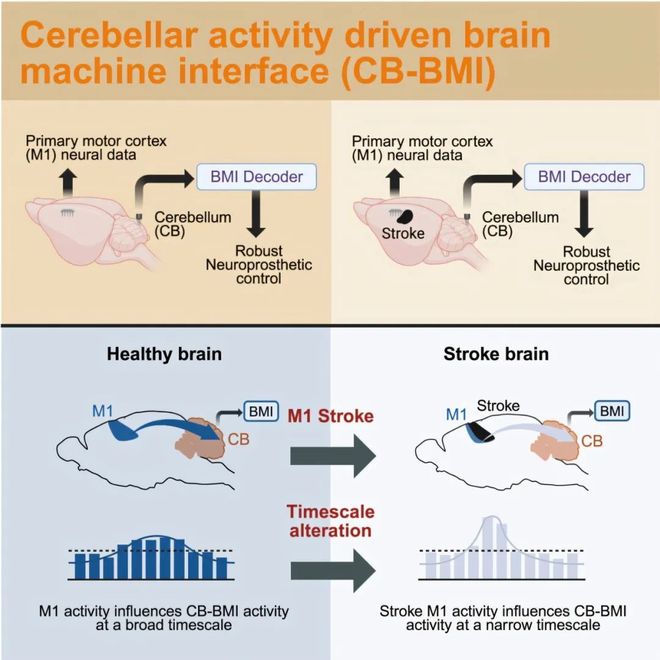
传统脑机接口(BMI)大多依赖大脑的运动皮层,但该区域恰恰是中风的重灾区。为绕过这一障碍,研究团队开发了一种直接从小脑读取信号的BMI。在实验中,他们训练因中风导致M1区受损的大鼠,仅使用小脑的神经活动来控制一个饮水装置。结果显示,这种小脑驱动的BMI不仅可行,其控制效果甚至能与健康大鼠使用M1驱动的BMI相媲美。这一发现至关重要,因为它证明了小脑可以成为一个功能强大的替代信号源。进一步分析发现,在中风后,大脑展现出惊人的可塑性:运动皮层与小脑的交互模式发生了重组,二者的通信从长时程延迟转变为短时程,这可能是大脑为补偿受损功能而进行的适应性调整。研究发表在 Cell Reports 上。
我们如何感知到情绪的“强度”?这种主观感受与心跳加速等生理反应在大脑中是同一回事吗?香港大学心理学系的 Benjamin Becker 教授团队,利用AI与脑成像技术,成功构建了一个能够量化主观情绪唤醒的模型,并首次清晰地揭示了大脑处理有意识的情绪感受与无意识的身体反应的神经机制是不同的。
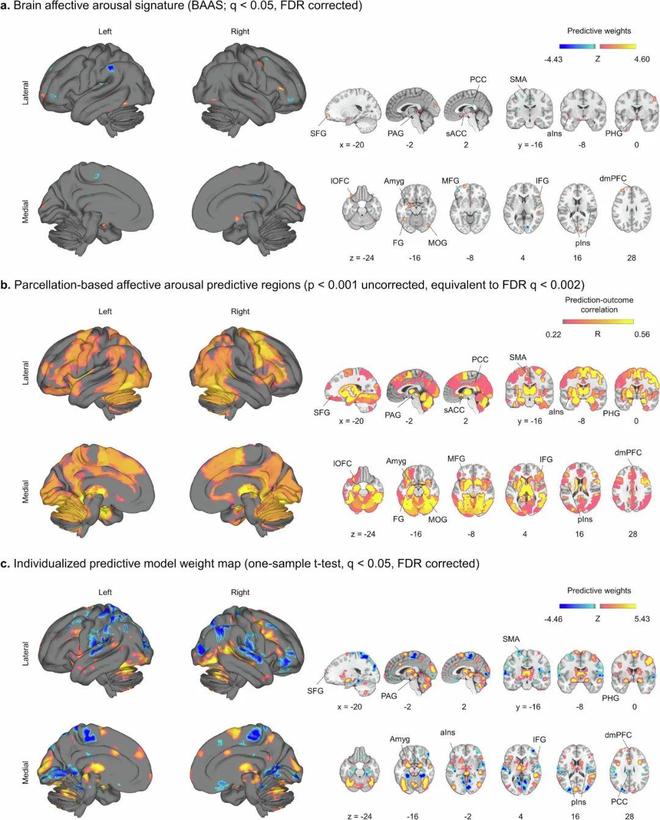
研究团队将人工智能驱动的建模(AI-driven modeling)与功能性磁共振成像(fMRI)相结合,创建了一个名为“大脑情感唤醒特征”(BAAS, Brain Affective Arousal Signature)的预测模型。在实验中,被试观看能引发从平静到强烈兴奋等不同情绪的视频,同时研究人员记录其大脑活动并收集其主观唤醒度评分。分析发现,BAAS能够跨越积极与消极情绪的界限,准确预测被试主观感受到的情绪强度。更重要的是,该研究证实了主观情感唤醒的神经模式与自主神经唤醒的模式是不同的。情感唤醒依赖一个广泛分布的大脑网络,包括前额叶皮层和中脑导水管周围灰质。这一发现解决了心理学长达一个半世纪的争论,也极具应用价值:通过BAAS剔除共通的“唤醒”信号后,能让其他针对特定情绪(如恐惧)的脑活动分析变得更加精准。研究发表在 Nature Communications 上。
线粒体压力如何具体改变细胞的身份和物理结构?由德国科隆大学CECAD老龄化研究卓越集群的 Aleksandra Trifunovic 领导,并与 Christian Frezza(CECAD)和 Sara Wickstrom(马克斯普朗克分子生物医学研究所)合作的团队,揭示了一条全新的信号通路。他们发现,线粒体功能障碍会产生一种代谢物,该物质不仅改变了细胞身份,还意外地“软化”了细胞核。
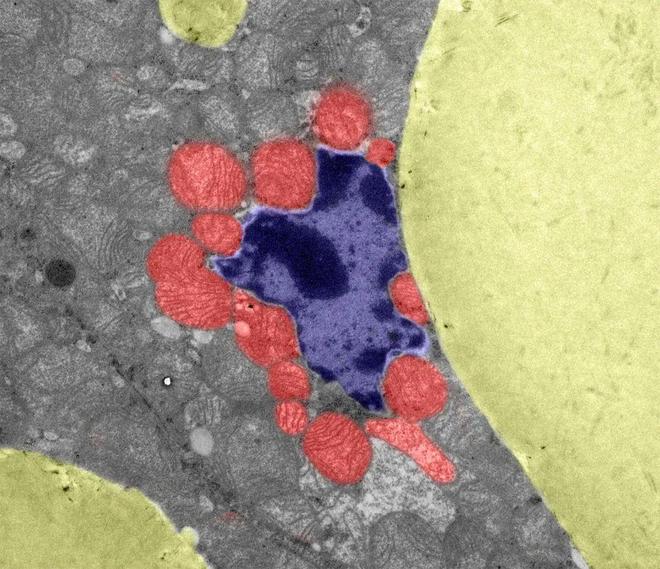
▷图像显示突变棕色脂肪组织的横截面,其中增大的脂滴(黄色)和细胞核(蓝色)受到多个线粒体(红色)的挤压。Credit: Harshita Kaul/Universität zu Köln
研究团队利用线粒体蛋白酶CLPP缺失的小鼠模型,在其棕色脂肪组织(BAT,一种通过燃烧脂肪产热的“好”脂肪)中诱导了线粒体功能障碍。研究发现,这种功能障碍并未导致细胞关闭,而是触发了一种复杂的代谢反应,导致一种名为D-2-羟基戊二酸(D-2HG)的代谢物异常积累。D-2HG通常被认为是一种致癌代谢物,但在该生理应激环境下,它扮演了关键的信号分子角色。D-2HG通过改变细胞核内的表观遗传标记,重新编程了基因表达。这一过程带来了两个惊人的后果:首先,它促进了棕色脂肪的“白化”(whitening),使其功能从产热转为储存脂肪;其次,它显著降低了细胞核的物理僵硬度(nuclear stiffness),使其变得更“软”。这一发现揭示了线粒体与细胞核之间一种前所未见的通讯方式,即通过代谢物直接影响细胞核的物理力学和基因程序,为理解代谢疾病和衰老提供了新视角。研究发表在 Nature Metabolism 上。
童年成长环境如何影响我们成年后的大脑决策?康奈尔大学(Cornell University)的 Minwoo Lee 和 Marlen Z. Gonzalez 探究了这个问题。他们将逆境细分为缺乏社会支持和经济资源两种情况,研究发现,成长于“社会富裕”(强社会支持,低经济水平)和“经济富裕”(高经济水平,弱社会支持)环境的人,虽然冒险行为相似,但其大脑达成决策所依赖的神经通路截然不同。
研究团队招募了43名大学生,并根据童年经历将其分为社会富裕型和经济富裕型。参与者在接受功能磁共振成像(fMRI)扫描时,玩了一个给气球充气的冒险游戏。结果显示,两组的冒险程度相似,但大脑活动模式存在显著差异。社会富裕的参与者在冒险时,会独特地激活与视觉和注意力处理相关的枕顶叶皮质。有趣的是,这种激活模式会受到他们当前社会支持水平的调节:当下的社会支持越强,他们大脑的这种额外活动就越少,反而更敢于冒险。此外,研究还在两组中共同发现,缘上回(supramarginal gyrus,大脑中与感知和语言处理相关的区域)的活动增强与更谨慎的行为有关,如同一个神经“刹车”系统。这一发现表明,即便最终行为一致,不同成长经历的人也是通过不同的神经认知策略来解决问题的。研究发表在 Cerebral Cortex 上。
“睡一觉再处理”为何总能见效?为了探明睡眠巩固记忆的具体神经机制,哈佛医学院的Dara S. Manoach及其团队(包括Martin Sjøgård, Dimitrios Mylonas, Robert Stickgold等研究人员)进行了一项研究,发现睡眠不仅是简单重播记忆,而是通过在不同大脑区域进行针对性的信息处理,从而实现技能的提升。
研究团队让25名参与者学习一项复杂的打字任务,并利用脑电图(EEG)和脑磁图(MEG)技术记录了他们在学习及随后午睡期间的大脑活动。研究的核心发现聚焦于一种名为睡眠纺锤波的节律活动。结果显示,经过学习训练后,参与者大脑中与打字任务相关的特定区域,在睡眠时会产生更多的纺锤波。更有趣的是,研究揭示了记忆巩固的分工机制:初始学习阶段的表现好坏,与睡眠时大脑运动执行区的纺锤波活动增强有关,这似乎代表了对所学技能的“存档”;而午睡后任务表现的提升程度,则与大脑运动计划区的纺锤波活动增强相关,这可能意味着大脑在为“未来的表现”进行优化和准备。这一发现表明,睡眠并非被动地存储信息,而是一个主动重塑和优化记忆的能动过程。研究发表在 Journal of Neuroscience 上。
冥想训练虽有益心理健康,但过程漫长且需要毅力。伦敦大学学院(University College London)的Sunjeev K. Kamboj及其团队研究发现,通过一种非侵入性的神经刺激技术,可以有效放大冥想训练带来的益处。他们的研究成果表明,迷走神经刺激与自我慈悲冥想相结合,能更快、更显著地提升个体的自我同情与正念水平。
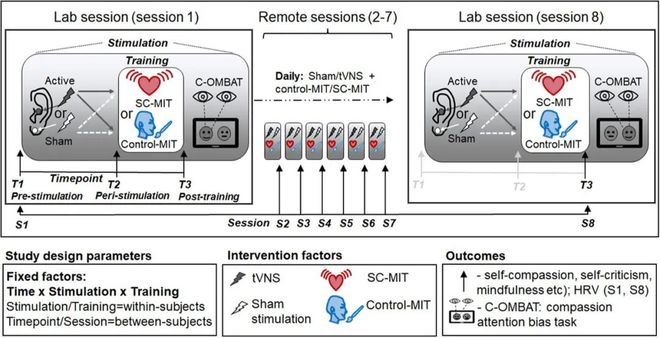
该研究对120名健康参与者进行了一项随机对照试验。参与者被分为四组,分别体验了真实或安慰剂的经皮迷走神经刺激(transcutaneous vagus nerve stimulation, tVNS,一种通过向耳部施加微弱电脉冲以非侵入方式激活迷走神经的技术)与自我慈悲冥想或普通心像训练的组合。结果显示,同时接受真实tVNS和自我慈悲冥想的参与者,其自我同情水平在单次训练后就获得了最显著的提升。此外,这种组合干预对正念的益处会随着训练次数的增加而累积。这表明,神经刺激不仅能带来即时效果,还能与冥想训练产生协同作用,加速并巩固其长期益处。研究人员认为,这项技术有望作为一种辅助手段,帮助那些在心理治疗中难以坚持的患者更快地获得改善。研究发表在 Psychological Medicine 上。
比赛不仅考验模型的策略推理能力,还设置了严格的规则:模型不能调用外部工具(如国际象棋引擎Stockfish),且必须在60分钟内完成每步决策。如果模型连续4次提交非法走法,将直接判负。谷歌DeepMind联合创始人Demis Hassabis表示,游戏是检验AI能力的绝佳试炼场,此次比赛将推动AI技术的进一步发展。
这场赛事标志着AI评估方式的新突破。传统基准测试已难以区分顶尖模型的性能,而Kaggle Game Arena通过实时对战和动态排行榜,为研究者提供了更直观的评估标准。观众可通过直播观看模型推理过程,见证AI如何在国际象棋中展现“真正的智能”。
人类在阅读时如何做到快速理解?这一过程涉及对后续内容的“期望”和从“记忆”中提取信息,但两种机制如何协同工作一直是未解之谜。Soo Hyun Ryu和Richard L. Lewis提出了一项开创性理论,他们利用基于Transformer架构的人工智能模型(GPT-2),首次成功地将这两种理论无缝整合,为理解人类句子处理机制提供了统一的计算框架。
研究人员提出,大语言模型处理句子的方式与人脑有惊人的相似之处。他们将GPT-2模型作为人类认知过程的计算模拟,验证了两个核心观点。首先,模型对下一个词的预测能力,通过词语惊奇度(surprisal,即一个词出现的意外程度)来量化,这对应了人类语言处理中的“期望”机制。其次,研究人员提出了一个新指标——注意力熵(attention entropy),通过分析模型内部注意力机制的分布情况,来衡量在理解当前词语时,从前文记忆中检索相关信息的难度。当多个相似信息相互竞争时,注意力变得分散,熵值增高,这对应了人类的“记忆干扰”现象。研究团队将这两个指标用于分析两个大型人类阅读实验(包含眼动追踪和自定步速阅读数据)的数据,结果显示,词语惊奇度和注意力熵能够共同且独立地预测人类的阅读时间。这表明,阅读中的卡顿既可能因为看到了意料之外的词,也可能因为从记忆中提取信息时遇到了困难。研究发表在 Journal of Memory and Language 上。
身体上的疼痛和失去亲人般的心痛能否被客观区分?准确评估疼痛类型对有效治疗至关重要。Eun-Hye Jang, Young-Ji Eum, Daesub Yoon和Sangwon Byun等研究人员提出了一种创新方法,利用机器学习分析多模态生理信号,成功实现了对身体疼痛和社交疼痛的分类。
研究团队对73名参与者进行了实验,通过手臂加压的方式诱发身体疼痛,通过观看悲伤视频诱发社交疼痛,并同步记录了他们心电图、皮肤电活动和手指温度等五种生理信号。研究人员利用这些数据训练了三种机器学习模型。结果显示,模型能以高准确率(身体疼痛0.90,社交疼痛0.82)从无痛的基线状态中识别出疼痛的发生。更有价值的发现是,虽然仅凭疼痛时的生理数据区分两种疼痛的准确率仅为0.63,但当模型考虑了参与者从平静到疼痛的生理“反应变化”后,区分准确率大幅提升至0.77。这一结果凸显了动态生理变化在揭示不同疼痛内在机制中的重要性,表明该技术有潜力发展为客观、个性化的疼痛评估工具,为未来的临床诊断和治疗提供支持。研究发表在 Scientific Reports 上。
网络仇恨言论与用户的心理状态有何关联?美国德克萨斯农工大学的Andrew William Alexander和Hongbin Wang团队,利用人工智能分析了社交媒体上的海量帖子。他们开创性地发现,仇恨言论社区的语言风格与某些精神障碍(特别是人格障碍)社区的语言风格惊人地相似,这为理解和干预网络极端言论提供了全新的心理学视角。
研究人员利用大型语言模型分析了Reddit上数千篇来自仇恨言论、虚假信息和各类精神障碍社区的帖子。他们首先通过GPT-3模型将帖子内容转化为包含语义信息的数字“嵌入”向量,然后运用机器学习和拓扑数据分析(topological data analysis,一种能揭示高维数据结构和关联的数学方法)来比较不同社区的语言模式。研究杏彩股份有限公司发现,仇恨言论的语言特征与B类人格障碍(Cluster B personality disorders,包括自恋型、反社会型和边缘性人格障碍)最为接近。研究者强调,这并非断定发表仇恨言论者患有精神疾病,而是指出二者语言模式的趋同性,这种现象可能源于两者共有的低共情、情绪不稳定等特质,而这些特质可能在仇恨言论社区中被不断强化。相比之下,虚假信息与精神障碍的语言关联则弱得多。这一发现或能启发借鉴心理治疗的策略来对抗网络上的有毒言论生态。研究发表在 PLOS Digital Health 上。
生成式AI如何被用于放大网络虚假信息?华盛顿大学的Saloni Dash, Yiwei Xu, Madeline Jalbert, Emma S Spiro等人研究了一种名为AIPasta的新策略,它利用AI将一条虚假信息改写成无数个看似独立但观点相同的帖子,从而制造“很多人都这么认为”的共识幻觉,这种新威胁比传统的复制粘贴更具欺骗性且更难被发现。
研究人员将这种新策略命名为AIPasta,以区别于传统的复制粘贴(CopyPasta)。他们首先选取了网络上流传的线年美国大选舞弊”和“新冠病毒为人为制造”的言论,然后使用ChatGPT生成大量措辞不同但核心信息一致的变体。在一项涉及1200名美国人的在线实验中,参与者被随机分配接触AIPasta、CopyPasta或不相关的控制信息。结果显示,虽然两种方法对普通大众的直接说服力有限,但AIPasta在制造共识幻觉(illusory consensus)方面表现突出,让人们误以为某个虚假观点得到了广泛支持。更令人担忧的是,对于那些政治立场上本就倾向于相信这些阴谋论的参与者,AIPasta显著增强了他们对虚假信息的信念。此外,研究团队测试发现,目前主流的AI内容检测器无法识别AIPasta,这意味着它可以在社交媒体上逃避审查,大规模传播。研究发表在 PNAS Nexus 上。
当前药物发现流程成本高昂、效率低下,且高度依赖偶然性。Known Medicine公司的研究人员Filipe Menezes, Adam Wahida及Grzegorz Maria Popowicz开发了一套全新的理论框架和机器学习模型,旨在通过精准预测药物与靶蛋白的相互作用,实现真正的合理化药物设计。
该研究提出了一种名为靶点偏好图(Target Preference Maps, TPMs)的创新模型。与传统方法不同,TPMs并不直接学习化学结构,而是通过分析超过100万个已知的配体-蛋白质复合物数据,学习两者之间非键合作用的“空间相互作用场”。它聚焦于蛋白质结合口袋内的局部原子微环境(local atomic microenvironments),从而摆脱对现有化合物库的依赖,具备向全新化学分子泛化的强大能力。该模型的核心产出是一系列高分辨率图谱,能够直观地显示出在结合口袋的特定空间位置,哪种类型的原子(如氢键供体、受体或疏水基团)会受到偏好或排斥。这为药物化学家提供了清晰的设计蓝图,指导他们如何优化分子结构以增强与靶点的结合。为了验证实用性,团队针对一个极具挑战性的蛋白质-蛋白质相互作用靶点,利用TPM模型指导设计并合成了新型抑制剂,实验证明其药效远超预期。模型甚至能捕捉到点突变、金属离子等精细结构变化带来的影响,展现了其在精准医疗领域的巨大潜力。
天桥脑科学研究院旗下科学媒体,旨在以科学追问为纽带,深入探究人工智能与人类智能相互融合与促进,不断探索科学的边界。如果您有进一步想要讨论的内容,欢迎评论区留言,或后台留言“社群”即可加入社群与我们互动。
天桥脑科学研究院(Tianqiao and Chrissy Chen Institute)是由陈天桥、雒芊芊夫妇出资10亿美元创建的世界最大私人脑科学研究机构之一,围绕全球化、跨学科和青年科学家三大重点,支持脑科学研究,造福人类。
Chen Institute与华山医院、上海市精神卫生中心设立了应用神经技术前沿实验室、人工智能与精神健康前沿实验室;与加州理工学院合作成立了加州理工天桥神经科学研究院。
Chen Institute建成了支持脑科学和人工智能领域研究的生态系统,项目遍布欧美、亚洲和大洋洲,包括、、、科研型临床医生奖励计划、、等。